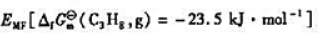题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应
已知电极反应:
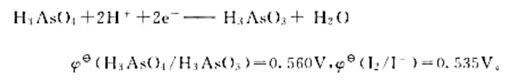
计算下列反应:
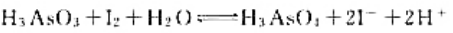
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知电极反应:
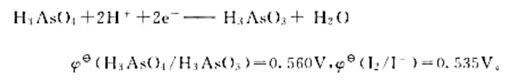
计算下列反应:
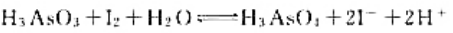
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
 答案
答案
 更多“已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应”相关的问题
更多“已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应”相关的问题
第1题
已知298.15K时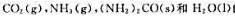 的标准摩尔生成焓和标准摩尔熵如下表所示:
的标准摩尔生成焓和标准摩尔熵如下表所示:

试通过计算判断下列反应
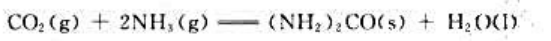
在298.15K、标准状态下能否自发进行。上述反应在标准状态下自发进行的最高温度是多少?
第2题
已知铅酸蓄电池
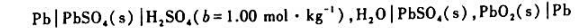
在25°C时的电动势E=1.9283V,Eθ=2.0501V.该电池的电池反应为
Pb(s)+PbO2(s)+2SO42-+4H+→2PbSO4(s)+2H2O
(1)请写出该电池的电极反应;
(2)计算该电池中硫酸溶液的活度a、平均离子活度az及平均离子活度因子γz;
(3) 已知该电池的温度系数为5.664x10-5V·K-1,计算电池反应的ΔrGm,ΔrSm,ΔrHm,
及可逆热Qr,m.
第3题
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
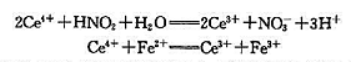
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.
第4题
已知下列各反应298K时的自由能改变量:
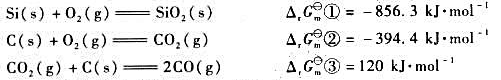
(1)试通过计算说明,制备单质Si的反应:
SiO2(s)+2C(s)=Si(s)+2CO(g)
在常温下不能自发进行。
(2)查热力学数据表,计算上述制备反应的 ,进一步计算该反应进行的最低温度要求。
,进一步计算该反应进行的最低温度要求。
第5题
(1)写出下列各电对的电极反应式,并根据元素电势图给出各电极反应的标准电极电势 。
。
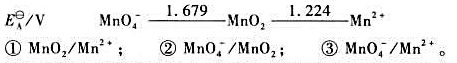
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势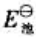 和电池反应的
和电池反应的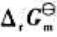 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势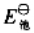 和电池反应的
和电池反应的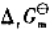 。
。
第7题
已知反应:
A+B→C+D1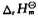 (T)=-40.0kJ·mol-1
(T)=-40.0kJ·mol-1
C+D→E1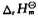 (T)=60.0kJ·mol-1
(T)=60.0kJ·mol-1
计算下列反应的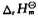 (T)。
(T)。
(1)C+D→A+B
(2)2C+2D→2A+2B ;
(3)A+B→E
第8题
已知下列原电池:
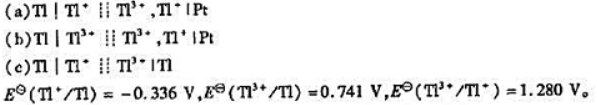
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的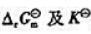 .
.
第9题
|PI的电动势为0.1705V.已知25℃时,ΔrGθm(H2SO4,水溶液)=ΔrGθm(SO42-,水溶液)=-744.53kJ·mol-1,ΔrGθm.(PbSO4,s)=-813.0kJ·mol-1.
(1)写出上述电池的电极反应和电池反应;
(2)求25°C时的 ;
;
(3)计算0.01mol.Kg-1H2SO4溶液的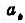 和
和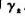 .
.
第10题
丙烷燃料电池的电极反应为
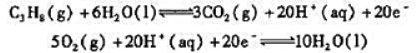
(1)指出正极反应和负极反应;
(2)写出电池反应方程式;
(3)计算25℃下丙烷燃料电池的标准电动势